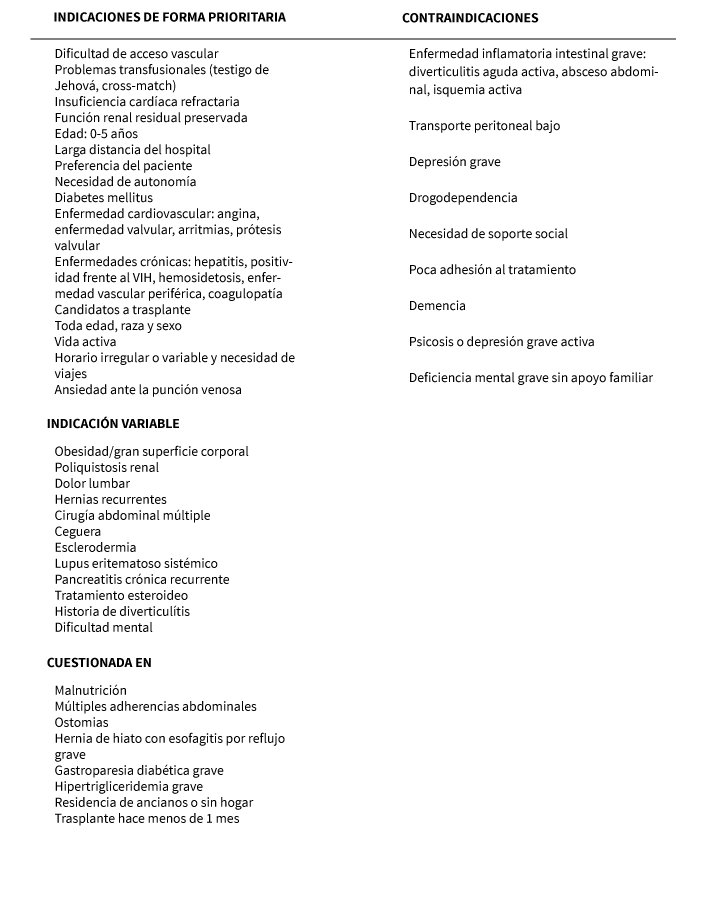Dialisis y Hemodiálisis.
Una revisión actual según la evidencia
Autores:
Pereira-Rodríguez Javier,
Boada-Morales Lorena,
Peñaranda-Florez Devi Geesel,
Torrado-Navarro Yoryely.
Rehabilitar Cúcuta IPS, Grupo De Investigación RehabilitarCI, Cúcuta – Colombia.
Correspondencia:
Ft. Esp. Javier Pereira Rodríguez:
Calle 13a #1E-49 Barrio Caobos. Rehabilitar Cúcuta IPS
C.P. 540001, Colombia
E-mail: rehabilitarcucuta.investiga@gmail.com
Phone: (037) 3102858873
RESUMEN
Este artículo contiene un análisis del tratamiento de sustitución renal, diálisis peritoneal y hemodiálisis. El objetivo es dar un concepto claro y preciso sobre esta técnica y evidenciar las ventajas y desventajas que este conlleva como también, las indicaciones y contraindicaciones al momento de escoger el tipo de terapia, que más se adecua a las necedades del paciente renal. La metodología que se utilizo fue la revisión de la literatura existente sobre la enfermedad renal y el tratamiento sustitutivo renal. Se analizaron artículos, libros y guías reconocidas para cumplir dicho objetivo. Entre los resultados que se encontraron; se analiza la enfermedad renal como un problema de salud pública exponiendo a la diálisis y hemodiálisis como tratamientos de alto costo, aunque es imprescindible que el enfermo renal lo empiece de manera inmediata cuando es indicado por el nefrólogo. Sus complicaciones, afectan su condición emocional, mental y social. Varios estudios demuestran una gran repercusión sobre la condición física, cuyo deterioro es inminente. A su vez, se logra concluir que las comorbilidades, edad, estado mental, apoyo social y el ejercicio físico influyen de sobremanera al éxito de la diálisis.
PALABRAS CLAVE: Diálisis, hemodiálisis, enfermedad renal, insuficiencia renal, sustitución renal, terapia renal.
ABSTRACT
This article contains an analysis of renal replacement therapy, peritoneal dialysis and hemodialysis. The objective is to give a clear and precise concept about this technique and to highlight the advantages and disadvantages that this entails as well as, indications and contraindications when choosing the type of therapy, that best suits the follies of the renal patient.
The methodology used was the review of existing literature on renal disease and renal replacement therapy. We analyzed articles, books and guides recognized to fulfill this objective. Among the results found; renal disease is analyzed as a public health problem exposing dialysis and hemodialysis as high-cost treatments, although it is essential that the renal patient starts it immediately when indicated by the nephrologist. Their complications affect their emotional, mental and social condition. different studies show a great impact on the physical condition, whose deterioration is imminent. At the same time, we conclude that comorbidities, age, mental status, social support and physical exercise greatly influence the success of dialysis.
KEYWORDS: Dialysis, Hemodialysis, Renal disease, Renal insufficiency, Renal Replacement, Renal Therapy
Introducción
Los riñones sanos eliminan los desechos de la sangre y el exceso de líquido del cuerpo. Sin embargo, cuando los riñones no funcionan bien, estos desechos y el exceso de líquido pueden acumularse en la sangre y causar problemas de salud (National Kidney Foundation, 2007)1.
Para hacer referencia a la diálisis y hemodiálisis se debe comprender acerca de las complicaciones renales, cuando los riñones dejan de cumplir su función como filtro de la sangre, por lo cual Paez, Jofré, Azpiroz y de Bortolli (2009) hacen referencia a la insuficiencia renal crónica (IRC) como una disminución progresiva y global de la función renal2; y de la tasa de filtración glomerular persistente por debajo de 15 ml/min por 173 m2 (Fondo colombiano de enfermedades de alto costo, 2014)3; dicha función renal alcanza un nivel inferior al 10% en la insuficiencia renal crónica terminal, estadío más grave de la enfermedad renal; durante el cual se hace necesaria para la supervivencia, la implementación de un tratamiento sustitutivo de la función renal mediante trasplante o diálisis (peritoneal continua o hemodiálisis)2.
La enfermedad renal crónica (enfermedad renal crónica ) es reconocida como un problema de salud pública. Yepes et al (2009) describe que es debido a la afectación por el rápido incremento de su prevalencia, y por el efecto de «iceberg» generado por el desconocimiento que se tiene de su magnitud real, debido tanto a la insuficiente captación como al subregistro de pacientes en estadíos tempranos4.
Se debe agregar que existen dos tipos de diálisis; la hemodiálisis y la diálisis peritoneal. La primera es realizada a través de una máquina también conocida como riñón artificial y la segunda se realiza a través de un catéter que va a la membrana peritoneal del abdomen para filtrar la sangre. Cabe agregar que según la Fundación Renal Iñigo Alvarez de Toledo, (s.f. párr. 1) entre las técnicas de terapia renal sustitutiva, es decir las que van a suplir la función del riñón, cuando éstos presenten un deterioro importante de entre el 5-15% de su capacidad, es necesario elegir la técnica dependiendo de las características del paciente y las recomendaciones del nefrólogo5.
Según las estimaciones realizadas por Katherine T. Milis (2010) citado por el Fondo Colombiano de Enfermedades de Alto Costo (2015) 497 millones de adultos mayores de 20 años tenían enfermedad renal crónica estadíos 1-5. Para el año 2015 se identificaron en Colombia 979.409 personas con enfermedad renal crónica . La prevalencia de esta patología fue de 2 personas por cada 100 habitantes, siendo más frecuente en el sexo femenino que el masculino6
Hay que mencionar que la enfermedad renal crónica afecta cerca del 10% de la población mundial. Según datos de la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH), en América Latina un promedio de 613 pacientes por millón de habitantes tuvieron acceso en 2011 a alguna de las alternativas de tratamiento para la sustitución de la función que sus riñones ya no podían realizar. Sin embargo, la distribución de estos servicios es muy inequitativa y en algunos países esa cifra fue menor a 200 (Organización Panamericana de la Salud, 2015, párr. 4)7.
El Fondo Colombiano de Enfermedades de Alto Costo (2015) predice que para el año 2015 se identificaron en Colombia 34.469 personas con terapia de remplazo renal (TRR), calculándose una prevalencia de 71,5 x 100.000 habitantes. La prevalencia de TRR en el país es menor en comparación con otros contextos, 715 partes por millón (ppm). Por ejemplo, según refiere Nala (2012) en Croacia para el año 2009, la prevalencia de TRR se estimó en 923 personas por millón, siendo de 1084.9 ppm en hombres y 772.1 ppm en mujeres. En relación con Rumania, Kadour, Armean, Valceanu (2015) identificaron un total de 10.168 pacientes con hemodiálisis y diálisis peritoneal para el año 2012. Kolenyk, Noordzij, Kolesnyk, Kulysky, Jager (2015) citan que Ucrania por su parte, identificó 5.985 pacientes reportados con TRR para el año 2012, con una prevalencia de TRR de 131,2 ppm6.
Definición
La diálisis es definida como un procedimiento terapéutico por medio del cual se eliminan sustancias tóxicas presentes en la sangre. Como ya se ha referido, el tratamiento de diálisis consiste en dos tipos de procedimientos: La hemodiálisis y la diálisis peritoneal.
El tratamiento de hemodiálisis (HD) consiste en dializar la sangre a través de una máquina que hace circular la sangre desde una arteria del paciente hacia el filtro de diálisis o dializador en el que las sustancias tóxicas de la sangre se difunden en el líquido de diálisis; la sangre libre de toxinas vuelve luego al organismo a través de una vena canulada2. Dicho procedimiento, es una técnica, que al contrario de la diálisis peritoneal, la sangre pasa por un filtro a una máquina, que sustituye las funciones del riñón, donde esta es depurada. Aunque, esta técnica no suple algunas funciones importantes del riñón, como las endocrinas y metabólicas. La Fundación Renal Iñigo Álvarez de Toledo refiere que suple las funciones de excreción de solutos, eliminación del líquido retenido y regulación del equilibrio ácido-base y electrolítico5.
La hemodiálisises un proceso lento que se realiza conectando el enfermo a una máquina durante aproximadamente 4 horas, 2 ó 3 veces por semana Guyton & Hall (1997) citado por Páez et al (2009). Además, señalan que el tratamiento de diálisis implica ingerir a diario una gran cantidad de medicamentos y seguir una dieta restringida en líquidos y alimentos2.
La diálisis peritoneal, es una técnica que usa el recubrimiento del abdomen (llamado peritoneo) y una solución conocida como dializado. El dializado absorbe los deshechos y líquidos de la sangre, usando el peritoneo como un filtro8. El líquido de la diálisis se introduce en la cavidad peritoneal a través de un catéter previamente implantado con una pequeña intervención quirúrgica, y se extrae una vez pasado un tiempo, en el que se ha producido el intercambio de solutos en la membrana. Dicha práctica, se realiza una media de 3 a 5 intercambios al día dependiendo de las necesidades del paciente. Es de resaltar, que la presente intervención se debe realizar en un medio adaptado de la residencia del paciente en el cual es muy importante la higiene y los cuidados de asepsia y antisepsia5.
Es necesario recalcar que las modalidades de hemodiálisis hospitalaria (hemodiálisis hospitalaria) y diálisis peritoneal continúa ambulatoria (diálisis peritoneal continua ambulatoria) tienen diferentes repercusiones en las personas. Para las personas en hemodiálisis hospitalaria, la diálisis se convierte en el eje de su vida, implicando grandes restricciones. Las que están en diálisis peritoneal continua ambulatoria tienen más flexibilidad de horarios y menos restricciones para los desplazamientos, pudiendo alcanzar una mayor compatibilidad con otras responsabilidades9.
Las ventajas e inconvenientes de ambos tratamientos han sido debatidas por varios autores, pero aún no se ha llegado a un acuerdo acerca de cuál de las dos es más beneficiosa.
Además de las características propias de la insuficiencia renal crónica y las que acarrea su tratamiento, Álvarez, Fernández y Vázquez et al (201l) citado por Contreras, Espinosa y Esguerra (2008) genera incertidumbre con respecto al futuro, la dependencia a la máquina de diálisis y al personal sanitario, las limitaciones en la dieta, los cambios en las relaciones sociales, familiares, en el aspecto físico y la situación laboral, entre otros10.
Por otro lado es importante analizar las ventajas y desventajas de realizar el tratamiento renal mediante la hemodiálisis y diálisis peritoneal, siendo estas de suma importancia al momento de elegir el tratamiento que más se adecue a las necesidades físicas y psicológicas que requiera el paciente renal (tabla 1).
Debido al tratamiento de diálisis el paciente se verá altamente comprometido en un deterioro físico. Suele presentar insomnio, fatiga, pérdida de movilidad, cansancio, palidez, hinchazón de pies y tobillos y una percepción de mal sabor en la boca debida a la falta de eliminación de desechos, lo que genera que se sienta limitado en su vida diaria y experimente sentimientos de minusvalía, incapacidad y debilidad10.
La terapia de reemplazo renal puede atenuar algunas de las anormalidades metabólicas de la enfermedad renal crónica , pero la pérdida de aminoácidos durante procedimientos dialíticos y la liberación de citoquinas, llevan a un mayor catabolismo proteico muscular y síntesis de proteínas de fase aguda. Los niveles elevados de citoquinas son además predictores de mortalidad cardiovascular11. Por lo que conviene recalcar que cuando se evalúan las dimensiones de la calidad de vida en los que a salud se refiere en estos pacientes; la dimensión física es la que suele verse más deteriorada y la que genera mayor insatisfacción en los pacientes hemodializados debido principalmente al llamado síndrome urémico, hipoalbúmina, presencia de diabetes y abceso vascular por infecciones y taponamiento10.
A su vez, un grupo de alteraciones presentes en los pacientes con enfermedad renal crónica terminal, son las alteraciones musculares. Siendo éstas, los factores limitantes más importantes de su capacidad funcional. El estilo de vida sedentario es una de las principales causas de la baja capacidad física y un factor de riesgo independiente de muerte en pacientes con enfermedad renal crónica terminal sometidos a HD. La capacidad física de los pacientes con enfermedad renal crónica terminal corresponde al 60% de una población de la misma edad con función renal normal11.
Indicaciones y Contraindicaciones
En una primera aproximación se podría establecer que la diálisis peritoneal estaría indicada en cualquier situación donde la membrana peritoneal (MP) se mantiene intacta. Sin embargo, existen numerosos condicionantes relacionados con el paciente (enfermedades asociadas, limitaciones anatómicas, edad, estado nutricional, entorno socio-familiar, aceptación de la técnica, grado de información, preferencia del paciente y su familia) y el equipo médico-sanitario que lo atiende (consulta pre-diálisis, experiencia del programa de diálisis peritoneal, características de la unidad, etc.), que van a influir en su indicación12. Las indicaciones y contraindicaciones de la diálisis peritoneal se describen en la tabla 2.
En la actualidad, no existe una contraindicación absoluta para el tratamiento sustitutivo de la IRC, hemodiálisis. La edad no es una contraindicación y, únicamente, se plantea no ofrecer este tratamiento a pacientes con dolor intratable (neoplásicos terminales) en estado vegetativo. En el caso de enfermedades malignas, se contempla la realización de hemodiálisissi se prevé una supervivencia superior a seis meses (González M y Mallafré J, 2009)13. Tanto las indicaciones como las contraindicaciones de la hemodiálisis se deben revisar previamente antes de optar por alguna de las terapias renales, en este caso descrito la hemodiálisis y si esta es conveniente para el paciente (tabla 3).
EVIDENCIA SOBRE LOS BENEFICIOS DE LA DIÁLISIS Y HEMODIÁLISIS
Las investigaciones que se han realizado acerca de la diálisis peritoneal y hemodiálisis, con respecto a sus beneficios y resultados es equivalente. Los resultados a largo plazo son similares y cuyos factores asociados son inherentes a la persona y son aquellos que ejercerán mayor influencia sobre los pacientes dializados. Por otra parte, las condiciones que son enlistadas en las diferentes investigaciones son: la edad, la presencia de diabetes, inicio de la diálisis urgente o programado, adherencia a este método terapéutico, complicaciones y las comorbilidades asociadas existentes; las cuales influyen en los resultados y la supervivencia al tratamiento por lo tanto; son similares para la diálisis peritoneal y la HD, que a su vez dependerán de las complicaciones derivadas. A continuación se explican según la evidencia el tratamiento que es más beneficioso para el paciente renal teniendo en cuenta también los factores que han sido descritos.
Actualmente, la Sociedad Española de Nefrología (2005) enlista las siguientes situaciones en diálisis según la evidencia científica las cuales sugieren que en la práctica, es habitual la ausencia de factores médicos que, de manera categórica, indiquen o contraindiquen la diálisis peritoneal (Evidencia B). La elección informada y razonada por parte del paciente debe ser el elemento fundamental de decisión. Cuando se hace así, la mayoría de los pacientes escogerían diálisis peritoneal frente a hemodiálisisen Centro (Evidencia B) 14.
Cuando se realiza una estratificación y un ajuste por comorbilidades, la diálisis peritoneal presenta un pronóstico equivalente o mejor en los grupos de pacientes no diabéticos, menos comórbidos y más jóvenes, prácticamente en todas las publicaciones15. Por otro lado, los pacientes de alto riesgo; como los diabéticos, pueden beneficiarse de un inicio más precoz. (Nivel de evidencia: C)16
Sin embargo, la HD, sobre todo en los estudios con población estadounidense y de forma menos importante los estudios holandeses, presenta un pronóstico para la supervivencia mejor para los pacientes diabéticos, con más enfermedad cardiovascular y edad a partir de los 45 años en el registro americano y de los 60 años en el holandés15.
Ahora bien, la diálisis peritoneal estaría indicada en todos los casos con enfermedad renal crónica, estadío 5, excepto en los que hubiera una clara contraindicación para la misma, generalmente derivada de un peritoneo inservible o de una concreta situación psico-social del paciente, o cuando el enfermo se negara a este tipo de terapia (Evidencia C)14. Para asegurar que la diálisis se inicia antes de que la TFG es < 6 ml/min, las clínicas deben tratar de empezar a 8-10 ml/min. (Nivel de evidencia: C )16.
Globalmente, no hay diferencias entre la diálisis peritoneal y la hemodiálisisen lo que se refiere a supervivencia (Evidencia B). La diálisis peritoneal es, incluso, mejor en los 2-3 primeros años de terapia; sin embargo, tras este período, la supervivencia es mejor en HD, sobre todo en pacientes mayores de 60 años y diabéticos (Evidencia B). La mejor supervivencia se ha visto en pacientes que siguieron un tratamiento integral, es decir que cambiaron de técnica terapéutica (diálisis peritoneal, HD) según sus necesidades (Evidencia B)14.
En cuanto al tiempo de permanencia en el tratamiento de diálisis se debe agregar que en la totalidad de los estudios se observa una ventaja en supervivencia inicial mayor para diálisis peritoneal, que en algunos análisis disminuye con el tiempo tornándose a favor de la HD, a partir del primer o segundo año, pero en otros esta ventaja inicial para la diálisis peritoneal se mantiene durante más tiempo, e incluso demuestran que no existen diferencias significativas a favor de la hemodiálisisni siquiera al final del seguimiento15.
Por consecuente, podemos evidenciar que no existen grandes diferencias entre optar por un tratamiento u otro, en lo referente a supervivencia y condiciones de salud del paciente. No obstante, los resultados serán distintos según la edad de la persona, el tiempo de inicio de la diálisis y como ya se ha mencionado las complicaciones y/o adyacentes de las personas, además de la adherencia al tratamiento y factores psico-sociales que pueden influir. Todo esto, dependerá de la misma forma del tipo de diálisis que sea escogido según las características del paciente, físicas, sociales, psicológicas, emociones y de conducta.
EJenfermedad renal crónica ICIO FÍSICO EN DIÁLISIS Y HEMODIÁLISIS
La insuficiencia renal crónica descrito por Pérez E, Hernández R, Garcia J, Aldama L, Bravo T y García A (2013) provoca un deterioro progresivo de la función renal, con aparición de trastornos en diversos órganos y sistemas que suele conducir al sedentarismo, y, por ende, al deterioro aún mayor de la función muscular, que suele agravarse durante los tratamientos dialíticos17. En consecuencia, la inactividad física se convierte en un factor perjudicial y agravante que contribuye a según Moreno E. Y Cruz H. (2015) al deterioro acelerado de la función renal, física, cardiovascular y calidad de vida de los pacientes con enfermedad renal crónica 18.
La inactividad física resulta totalmente perjudicial si tenemos en cuenta que es un factor de riesgo y profundiza las enfermedades cardiovasculares asociadas a la Insuficiencia Renal Crónica. Además, empeora las enfermedades reumáticas que tienen una alta frecuencia en los enfermos dialíticos Fayad S. y Escalona R, Feraud G. (2005)19. Desde hace años, aparece el ejercicio físico como una alterativa terapéutica que acompaña el tratamiento de sustitución renal en diversos países. López O. (2003) mencioná, que las modalidades de aplicación del ejercicios son básicamente tres: ejercicio supervisado en días de no diálisis, ejercicio en casa o ejercicio durante la hemodiálisis. Esta última modalidad ha demostrado ser la que mayor seguimiento por parte del paciente consigue20.
La actividad física en niveles adecuados y prescritos regularmente permite contribuir positivamente al impacto de la pérdida de masa muscular y debilidad, baja capacidad aeróbica, capacidad de reserva vascular, fragilidad y discapacidad; donde estos últimos se evidencian en una calidad de vida comprometida en la enfermedad renal crónica, Moreno E. Y Cruz H. (2015)18.
Así mismo, se debe agregar que la mayoría de literatura en el campo del ejercicio durante la hemodiálisis se refiere a programas aeróbicos, mediante el uso de bicicletas adaptadas a la cama o sillón donde el paciente realiza la hemodiálisis. Dichos programas han demostrado mejorar la calidad de vida de los pacientes. En algunos casos, este tipo de ejercicio se ha combinado con ejercicio de resistencia, con el objetivo de fortalecer los miembros inferiores20.
Entre los cambios resultantes de la insuficiencia renal crónica, se producen disfunciones musculares, donde estudios han demostrado la presencia de atrofia de las fibras musculares resultantes de un desequilibrio entre la síntesis y la degradación de la proteína muscular. Incluso, puede haber disminución de la síntesis y/o aumento de la degradación. Diversos mecanismos conducen a la disfunción muscular, entre los cuales se encuentran: el agotamiento de aminoácidos; inflamación crónica; inactividad física; síndrome de malnutrición; cambios en la perfusión capilar; neuropatía periférica, entre otros18. Por ende, se relaciona que el entrenamiento físico terapéutico en este tipo de pacientes va a disminuir la morbilidad de la enfermedad y mejora la calidad de vida de estos enfermos19, además de influir sobre los cambios físicos y fisiológicos de la persona portadora de esta enfermedad. Tambien, hay un aumento de la masa corporal y de la resistencia, lo cual contribuye a que se soporte mejor la hemodiálisis disminuyendo la morbilidad durante este tratamiento; además de ayudar con la espera de un trasplante cuando sea necesario.
Según todo lo anterior, aparece así la necesidad de complementar y acompañar los procesos de la Rehabilitación Renal con la participación del Fisioterapeuta como promotor del movimiento corporal humano desde las áreas de prevención secundaria, terciaria y la rehabilitación con el objetivo de disminuir el impacto negativo de la carga de la enfermedad en el paciente y cuidador18.
Sin embargo, es necesario que antes de la realización de ejercicios, sea del conocimiento del equipo interdisciplinario todos los cambios y complicaciones que sufre el paciente renal, debido a los síntomas y alteraciones metabólicas y humorales que afectan su capacidad física, independencia y autoestima; así como un grupo numeroso de repercusiones negativas en diversos sistemas y aparatos, los que de conjunto deterioran su salud y calidad de vida. Se conoce además, que la inactividad física que suele acompañar a estos pacientes, es un importante factor en el agravamiento de sus dolencias, incluida su incapacidad para realizar sus labores cotidianas, factor que suele potenciarse en individuos en avanzada edad17.
Debido a lo mencionado, se puede resaltar la labor del fisioterapeuta con el ejercicio terapéutico, entre los beneficios de esta intervención con el paciente de insuficiencia renal crónica, descritos por López O. que menciona; facilitar la independencia funcional del paciente en Actividades Básicas Cotidianas y en actividades laborales mediante el reacondicionamiento físico (abandonando el sedentarismo), disminuir dolores osteomusculares por inactividad física, atrofia muscular por desuso, espasmos musculares por mala postura, dolor muscular por estrés, calambres por disbalance electrolítico, corrección de posturas inadecuadas cotidianas y durante la hemodiálisis, reacondicionar al organismo para tolerar el desgaste físico ocasionado por el tratamiento integral de la insuficiencia renal crónicamanteniendo la capacidad de movimiento (coordinación, postura y equilibrio), la masa muscular y la integridad del sistema osteoarticular20, entre otros beneficios a nivel cardiopulmonar y emocional.
En el presente, gracias a múltiples investigaciones se conoce que los enfermos entran en un círculo vicioso que los conduce a un mayor deterioro de sus capacidades física: la debilidad muscular y el malestar general propiciado por la hipertensión arterial y la anemia, entre otros factores, inducen al paciente a la inmovilidad y el sedentarismo, lo que les produce cada vez mayor debilidad y, en consecuencia, mayor inactividad. Teniendo en cuenta lo anterior, desde las últimas décadas se presta atención al entrenamiento físico como una estrategia terapéutica ventajosa para reducir la morbilidad y la mortalidad en los pacientes con IRC, en particular los que son sometidos a diálisis17.
Igualmente, la terapia de sustitución renal se sugiere debido a las investigaciones realizadas y a la evidencia que debe ir de la mano del ejercicio terapéutico, para mejorar la calidad de vida de los pacientes, disminuir la morbilidad y la mortalidad durante el tratamiento, además de contribuir con la condición física lo hace con la condición mental y emocional del enfermo renal.
Conclusiones
Según la evidencia actual, se puede concluir que el tratamiento de reemplazo renal es una técnica agresiva que genera deterioro físico, mental, social y emocional al paciente, pero es de suma importancia iniciarla tan pronto como sea posible y este indicada de manera inmediata eligiendo de forma adecuada el tipo de diálisis, ya sea peritoneal o hemodiálisis que más se ajuste al tipo de paciente.
Hay que mencionar, que la influencia del tiempo de terapia renal es definitiva al momento de evidenciar un mejor pronóstico, los cuales demostraron ser muy similares en los dos tipos de tratamiento. Las comorbilidades, la edad, el estado mental y el apoyo social influirán de sobremanera al éxito de la diálisis; sin embargo, se debe tener en cuenta que es un tratamiento que deberá seguir el enfermo renal de por vida y deberá adoptarlo en su rutina diaria, ya sea que lo realice en casa o en un centro hospitalario o en otro caso que esto no sea suficiente o adecuado para él y su solución sea el trasplante renal.
Se recalca la importancia del ejercicio físico y la fisioterapia como tratamiento que acompañe y complemente la terapia de sustitución renal para contribuir a la mejora de las condiciones físicas, mentales y sociales del paciente con enfermedad renal crónica .


 Tabla 1: Ventajas y desventajas del tratamiento de hemodiálisis y diálisis peritoneal.
Tabla 1: Ventajas y desventajas del tratamiento de hemodiálisis y diálisis peritoneal.