INSUFICIENCIA RENAL AGUDA Y SEPSIS
Autores:
Dr Bruno Lococo
Dra Bernarda Fazzini
Dra: Quevedo Alejandra
Dr: Renzo Tais
Dra: Ana Malvar
Servicio de Nefrologia del Hospital Fernandez
Resúmen
La lesión renal aguda (AKI) adquirida en el hospital es generalmente el resultado de una combinación de lesiones. Las causas más comúnmente asociadas son el fracaso de la autorregulación renal, nefrotoxicidad directa, isquemia reperfusión y estados inflamatorios. La gravedad de la AKI predice los resultados adversos, tales como la necesidad de tratamiento de reemplazo renal, la duración de la estancia hospitalaria y la mortalidad . Además el uso generalizado de RIFLE y los sistemas de clasificación de la red de la lesión renal aguda (AKIN) ha demostrado que incluso pequeños cambios en los niveles de creatinina se asocian con la mortalidad aumentada a corto y largo plazo. Por otra parte, efectos distantes de la AKI contribuyen a la disfunción de otros órganos como corazón pulmón, cerebro e hígado. En consecuencia, la prevención primaria y el diagnostico temprano de la AKI son de importancia clínica central. Una vez que se ha detectado un descenso en el índice de filtración glomerular, la prevención secundaria para atenuar los efectos de la lesión y el ratamiento de las consecuencias de la lesión son necesarias.
ABSTRACTS
Acute Kidney injury (AKI) acquired in the hospital is often the result of a combination of insults. The most commonly associated causes are a failure of renal autoregulation mechanisms, direct nephrotoxicity, ischemia-reperfusion issues, and inflammatory states. AKI severity predicts adverse outcomes, such as requirement for renal replacement therapy (RRT), length of hospital stay, and mortality. In addition, the widespread use of the RIFLE and Acute Kidney Injury Network (AKIN) classification systems has shown that even small changes in creatinine levels are associated with short and long term increased mortality. Furthermore, the long-term effects of AKI contribute to dysfunction of other organs, such as the heart, lung, brain and liver. Consequently, primary prevention and early diagnosis of AKI are of central clinical importance. Once a decline in glomerular filtration rate (GFR) has been detected, secondary prevention to attenuate the effects of injury and treatment of the consequences of injury are necessary.
Definición
La lesion renal aguda (AKI) es un síndrome clínico identificado por un brusco descenso en el índice de filtración glomerular (GFR), suficiente para disminuir la eliminación de productos de desechos nitrogenados (urea y creatinina) y otras toxinas úremicas. Tradicionalmente esto se ha denominado como Insuficiencia Renal Aguda (ARF), pero en los últimos años se ha hecho un esfuerzo para implementar el término lesión renal aguda en su lugar y desarrollar una definición estandarizada de la AKI. Una definición propuesta de la AKI es disminución de la función renal durante 48hs como se ha demostrado por un aumento de la creatinina sérica de mas 0.3mg/dl,o un aumento en la creatinina sérica de más del 50% o el desarrollo de oliguria.
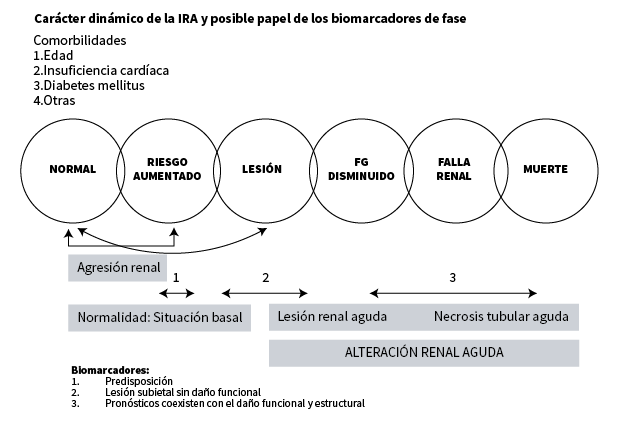
En la (AKI) inicialmente es una agresión isquémica o tóxica, sufrida por el riñon que ocasionaria lesiones subletales en las estructuras renales. Las lesiones subletales comenzarián a aparecer en plasma y/o orina, sustancias como enzimas, moléculas de nueva expresión o moleculas proinflamatorias que nos indican que el riñon ha comenzado a alterarse.En su inicio la disfunción renal aguda no se acompaña de aumento de los productos nitrogenados 1, pero si de estos nuevos marcadores.
- Cistatina C: es una proteína extracelular de bajo peso molecular y carga positiva, que se sintetiza en forma constante por todas las células nucleadas del organismo. Es probablemente el biomarcador más estudiado en el contexto que nos ocupas y el primer candidato a sustituir a la creatinina sérica. Se filtra en forma libre por los glomérulos siendo reabsorbida y catabolizada en el túbulo proximal de forma que su concentración en suero refleja fielmente la filtración. A diferencia de la creatinina su concentración sérica no depende de la masa muscalar, ni el sexo o la edad ni se afecta con los procesos inflamatorios y su determinación es menos susceptible.. En el contexto de la IRA se ha usado tanto en la detección precoz en pacientes en UTI, como en la estratificación de la gravedad 2,3,4
- N-GAL: es una proteína conocida como diserocalina o lipocalina 2, pertenece a la superfamilia de los lipocalinas, también pertenecen a dicha familia la proteína ligada al retinol (RBP, otro biomarcador de IRA). La N-GAL es uno de los biomarcadores más estudiados en la IRA posiblemente por su rápida expresión y detección en orina, antecediendo a las elevaciones de creatinina sérica en días.5,6
- KIM-1: es una glicoproteína transmembrana tipo 1 perteneciente a la familia de las inmunoglobulinas. Es fabricada por las células del túbulo proximal, pero no es detectable en tejido renal sano. Su síntesis aumenta de forma marcada en respuesta a la isquemia y algunos nefrotóxicos (cisplatino). La lesión del epitelio tubular proximal ( es el más sensible a la isquemia a la hipoperfusión) hace que la porción extracelular de KIM-1 se rompa, pudiendo detectarse en la orina a las pocas horas.7
- IL-18: La interleucina 18 es una citosina proinflamatoria mediadora de la inflamación en muchos órganos. Se induce en el túbulo proximal en respuesta a la isquemia detectándose en orina a las pocas horas del insulto.8
En los primeros años del 2000 se comenzó a realizar la diferenciación entre ARF y AKI por el grupo Acute Dialysis Quality Initiative (ADQI) y posterior la creación de una red de trabajo, la Acute Kidney Injuria Network (AKIN).
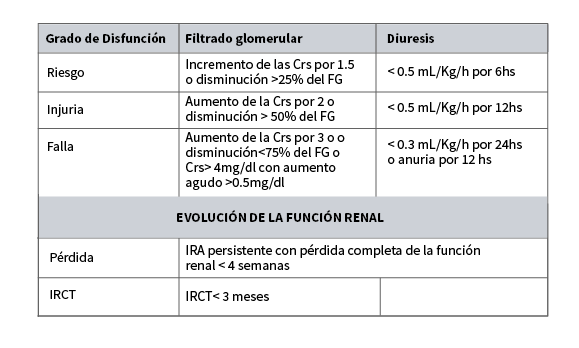
La clasificación de ADQI crea el RIFLE, que gradua el deterioro de la función renal en cinco escalones a los que denomina con las iniciales de las palabras inglesas correspondientes a risk (riesgo), injury (daño), failure (fallo),loss (pérdidas prolongada de la función renal) y end (fin irreversible de la función renal).9,10,11
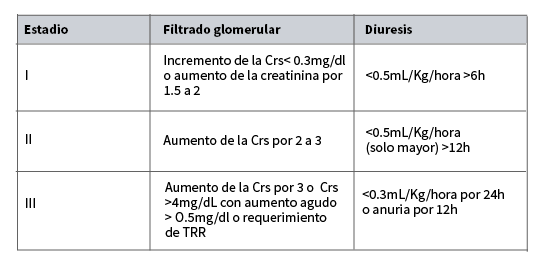
AKIN 5,6 establecio tres estadios de IRA,basados solamente en el grado de disfuncion renal y elimina los estadios de evolucion del (RIFLE). Estos criterios incluyen un perfil temporal (menos de 48hs), recogen los criterios de incremento de Crs y la disminucion del volumen urinario. Y con diferencia con el RIFLE agrega a la definición un incremento de la creatinina mayor o igual a 0.3mg/dl
Criterios de Rifle
Acute Kidney Injuria Network (AKIN)
INCIDENCIA Y ETIOLOGIA DE LA FALLA RENAL AGUDA(AKI)
AKI ocurre entre el 35% a 65% de pacientes que ingresa a Unidad de Terapia Intensiva y entre el 5% a 10% en sala general. La mortalidad sufre un incremento entre tres a cinco veces con respecto a pacientes sin AKI. Los pacientes que mejoran su función renal tienen mayor probabilidad de recurrir a una nueva internación comparado con paciente sin AKI y de evolucionar a la Insuficiencia Renal Cronica.12
Clasificación de la Injuria renal aguda (AKI)
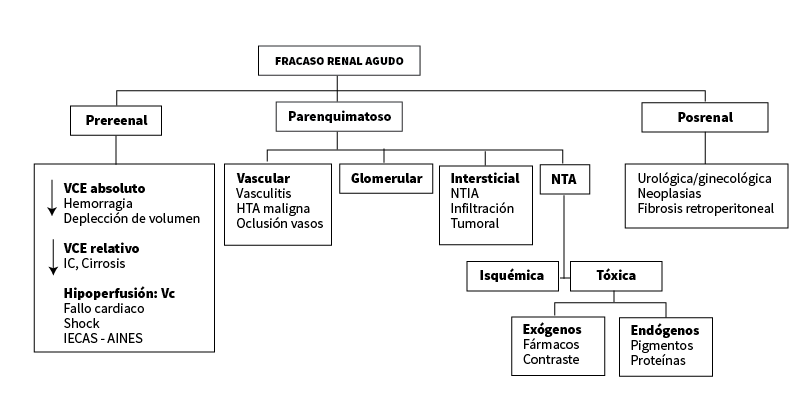
Se clasifican dependiendo del elemento funcional alterado, como:
- Prerrenal
- Parenquimatosas
- Obstructiva o posrenal
FISIOPATOLOGIA DE LA LESION RENAL AGUDA PRERRENAL
La disminución de la perfusión renal con caída de la presión de filtración glomerular capilar es una causa común de AKI. En esta ocasión la función renal tubular es normal, la reabsorción renal de sodio y agua se incrementa y en consecuencia en la orina hay un bajo sodio (< 20mmol/l), orina concentrada (osmolalidad de >500mOsm/kg), siempre que no se haya admistrado diuréticos de asa.
Una disminución de la perfusión renal puede trastocar la autorregulación y precipitar una caída aguda del GFR. Con un menor grado de hipoperfusión renal, las presiones de filtración glomerular y el GFR se mantienen por la vasodilación de las arteriolas aferentes (mediada por eicosanides y vasodilatadores) y la vasoconstricción arteriolar eferente (mediado por la angiotensina II).
La AKI prerrenal es habitualmente secundaria a la disminución del volumen de líqido extracelular como consecuencias de perdidas gastrointestinales, renales, dérmicas o posible secuestro de fluido denominada tercera espacio 13.
Causas Prerenales
- Disminución del volumen extracellular efectivo: Perdida renales, hemorragia,, vómitos, diarreas, quemaduras, laxantes, diuréticos.
- Por redistribución: Hepatopatías, síndrome nefrotico, obstrucción intestinal, pancreatitis, peritonitis, malnutrición.
- Disminución del gasto cardiaco shock cardiogénico, valvulopatías, miocarditis, infarto agudo de miocardio, arritmias, insuficiencia cardíaca congestiva, tromboembolismo pulmonar, taponamiento cardiaco
- Vasodilatacioٴn periférica (fármacos antihipertensivos, sepsis, hipoxemia, shock anafiláctico, tratamientos con IL-2 o interferón, síndrome de hiperestimulación ovárica)
- Vascoconstricción renal (inhibición síntesis de prostaglandinas, agentes alfa adrenérgicos, sepsis, síndrome hepatorrenal, hipercalcemia)
- Vasodilatación de la arteriola eferente (IECA-AARAll)
FISIOPATOLOGIA DE LA LESION RENAL AGUDA PARENQUIMATOSA
La necrosis tubular aguda ocurre comúnmente en pacientes de alto riesgo, que incluyen cirugía vascular y cardiaca, quemaduras graves , pancreatitis, sepsis y enfermedad hepática crónica. NTA (necrosis tubular aguda) es responsable de la mayoría de casos de AKI adquirida en el hospital y suele ser consecuencia de una lesión isquémica o nefrotóxica. En la unidad de cuidados intensivos, dos tercios de AKI son el resultado de la combinación de la perfusión renal alterada, sepsis y agentes nefrotóxicos.
Las características típicas de la NTA en la biopsia renal incluyen vacuolización y pérdida del borde cuticular de las células del túbulo proximal La descamación de las células tubulares hacia la luz conduce a la obstrucción tubular, que se manifiesta con dilatación tubular. El edema intersticial puede producir túbulos ampliamente espaciosos y una leve infiltración de leucocitos puede estar presentes.14,17
Causas Parenquimatosa
- SEPSIS:
Sepsis es la primera causa de contribuir a mas de un 50% de casos de AKI, lo cual incluye causas severa que requiere terapia de reemplazo renal, la incidencia se incrementa con la severidad de la sepsis. Los pacientes con sepsis pueden evolucionar en pacientes con normal, disminuido o aumentado el flujo renal, en un cuadro séptico el riñon frecuentemente tiene una histología normal al inicio. - HIPOTENSION:
Hipotensión es un importante factor para progresar AKI y muchos pacientes con AKI. El tratamiento con fluidos puedo ser suficientes aunque muchos pacientes requieren terapia vasoactiva para mantener la presión arterial.Esta terapias puede ser ej:noraepinefrina que se ha visto que no tiene un incremento mayor para el riesgo de AKI comparada con dopamina y se a encontrando en estudio con animales que la noraepinefrina incrementa el flujo renal. - POSOPERATORIO:
El posoperatorio es un factor de riesgo para progresar AKI por hipovolemia, hipotensión, cirugías abdominales complejas y sepsis. Las cirugías ginecológicas pueden complicarse por daño del tracto urinario bajo con nefropatía obstructiva. Aneurisma de Aorta puede estar asociado con disrupción de la arteria renal, cirugías cardiacas puede estar asociadas con ateroembolismo, hemolisis y reducción de la tensión arterial como también con inflamaciób sistémica. - OTRAS CAUSAS
Nefrotoxicos: Pueden causar falla renal en forma directa por injuria tubular, nefritis intersiticial o obstrucción tubular.
Rabdomiolisis: Presenta mioglobinuria y incremento creatininkinasa (CPK) en sangre en pacientes con traumatismo severo, convulsiones coma etc. Frecuentemente elevada las transaminasas hepáticas y la lactato deshidrogenasa LDH.
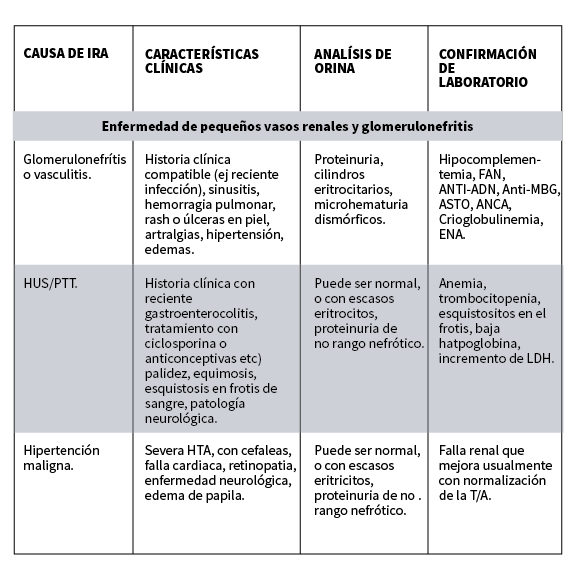
Enfermedades glomerulares: Paciente con proteinuria, hematuria o microhematuria dismorfica, hipertensión arterial, purpura, artralgias, vascultis, con deterioro de la función renal sugiere una enfermedad glomerular (ej una Glomerulonefritis Extracapilar) el diagnostica de certeza es una punción biopsia renal.
Sindrome urémico hemolítico: se caracteriza por anemia hemolítica microangiopatica, uremia y trombocitopenia.
Nefropatia por cristales: Se sospecha por la presencia de cristales en el sedimento urinario. Al microscopio se examinan los cristales confirmando el diagnostico si se encuentran uratos, oxalatos en gran cantidad. La liberación de purinas y uratos son responsables de la ARF en lisis tumoral.
Enfermedades renovasculares: la disminución del flujo renal puede ocurrir en afectación de grandes vasos por (Tromboembolismo arterial, trombosis venosa renal), de pequeños vasos (ateroembolia de colesterol, microangiopatia trombotica, ira posparto, síndrome antifosfolipidico etc) ,la disminución del flujo renal puede disminuir también por inestabilidad hemodinámica o el uso de drogas (ej DAINE, inhibidores de la enzima convertidora etc).
FRA y embarazo: En el primer trimestre: Aborto séptico, hiperémesis gravídica, entre el segundo y tercer trimestre del embarazo: falla hepática fulminante por hígado graso, Sindrome de Hellp, preeclampsia o eclampsia, SUH-PPT posparto, Isquemia por hemorragia posparto, abruptio placentario, embolo en liquido anmiotico.
FISIOPATOLOGIA DE LA LESION RENAL AGUDA POSRENAL
En todo paciente con AKI se debe excluir una causa obstructiva debido a que la rápida intervención puede resultar en mejoría o recuperación completa de la función renal. Las formas posrenales de AKI se dividen en intratubular y extrarrenal. La precipatición de cristales insolubles tubulares (fosfato, oxalato, acido úrico metotrexato, Aciclovir, sulfonamidas, indinavir, triamtereno) o proteínas (hemoglobina, mioglobulina, paraproteína) pueden aumentar la presión intratubular. Si es lo suficiente alta, esto se pone a la presión de filtración glomerular y puede disminuir el GFR. Del mismo modo, la obstrucción del sistema colector extrarenal en cualquier nivel (pelvis renal, uréteres, vejiga o uretra) puede conducir a la AKI postrenal. La uropatía obstructiva es común en hombres mayores con enfermedad prostática y en pacientes con un único riñón o cáncer intraabdominal, particularmente pélvico. La obstrucción ureteral severa también se ve con fibrosis retroperitoneal. La mayoría de las causas de uropatía obstructiva son susceptibles a tratamiento, el pronostico es generalmente bueno, que depende de la enfermedad subyacente. 14,17
Causas Obstructiva:
- Anomalías congénitas
- Uropatias adquiridas(Hipertrofia benigna de próstata, litiasis, necrosis papilar, coágulos, etc).
- Neoplasis pelvicoabdominales
- Fibrosis retroperitoneal
- Ginecológicas no neoplásicas (asociadas a embarazo, cistocele, prolapsos uterinos, endometriosis)
- Nefropatia aguda por cristales (ácido úrico, retrovirales, sulfamidas, etc)
- Infecciosas
Diagnóstico Diferenciales de la Ira

FACTORES DE RIESGO
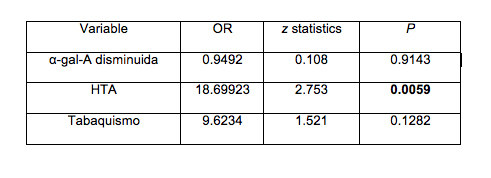
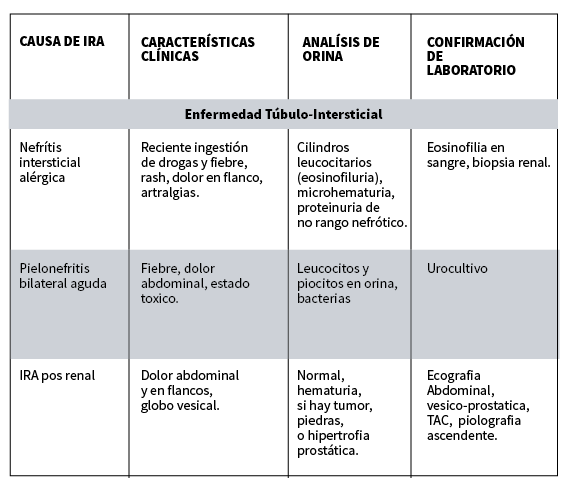
Los factores de riesgo para desarrollar FRA han sido descripto ampliamente en la literatura. Estos factores, además se combinan entre si creando el espectro del paciente en Terapia Intensiva con falla renal. El peso específico de cada factor a la hora de provocar FRA se desconoce, si bien se ha encontrado mayor asociación con la sepsis y la insuficiencia cardiaca.
En cuanto a riesgos de base, varios estudios han señalado la frecuencia con que el desarrollo de FRA se asocia a enfermedades previas. Existe una amplia evidencia científica que señala la edad avanzada, la diabetes, la insuficiencia renal previa la insuficiencia cardíaca como factores de riesgo para desarrollar FRA.
Sobre estos factores de riesgo de base pueden actuar determinadas situaciones clínicas que precipitan el FRA. De todas ellas, la más ampliamente descrita es la sepsis (hasta en la mitad de los casos), seguida por el shock séptico. De Mendonca y cols describieron como factores de riesgo mayores la presencia previa, principalmente de insuficiencia cardiaca , seguida de infección, cirrosis y neoplasias hematológicas.
A pesar de que no se ha hallado el mecanismo fisiopatológico, se ha descripto asociación entre la ventilación mecánica y el desarrollo de FRA. En pacientes con cirúgia cardiovascular, el mayor determinante descripto para desarrollar FRA es la duración del clampaje aórtico. La necesidad del uso de sustancias o fármacos nefrotóxicos es habitual en pacientes críticos, hecho que les predispone especialmente a desarrollar FRA grafico 15,16,17,18
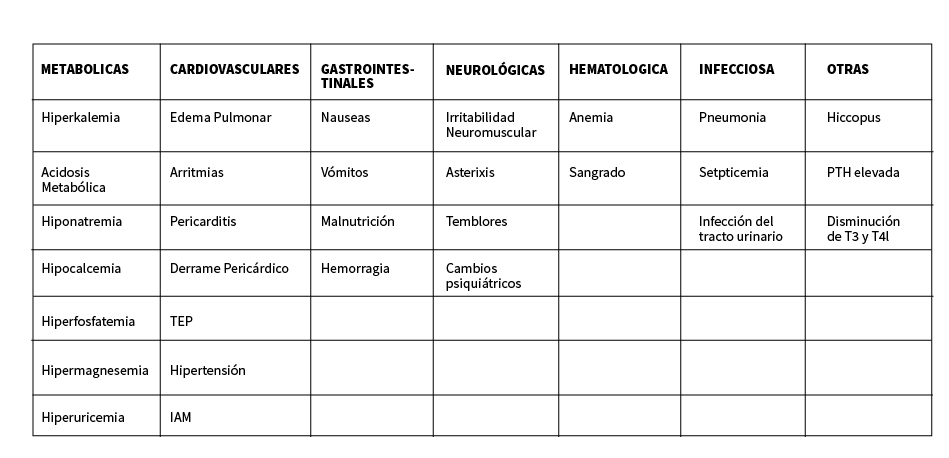
Complicaciones comunes de la ira

DEFINICIONES DE COLONIZACION, INFECCION Y SEPSIS
- Colonización : Presencia de microorganísmo en una superficie epitelial o mucosa
- Infección: Fenomeno microbiológico caracterizado por la invasión de microrganismos o toxinas de un tejido del huésped normal o esteril.
- Sepsis:
A. Sindrome de respuesta inflamatoria sistémica (SIRS) es un síndrome caracterizado por la presencia de dos o mas de las siguientes condiciones como respuesta a un estimulo inflamatoriio agudo.
- Temperatura > de 38 o < de 36
- Frecuencia cardiaca > 90 latidos por minuto
- Frecuencia respiratoria >20 respiraciones por minuto o PaCO2 < de 32mmHg.
- Leucocitos >12000uL o < 4000/uL
- Sepsis Severa: Sepsis asociado a disfunción organica
- Shock Septico: Sepsis con hipotensión refractaria a reposición de volumen asociada a anomalías de la perfusión que producen, acidos láctica, oliguria, alteración aguda de nivel de conciencia.
RESPUESTA DE FASE AGUDA EN LA SEPSIS
La respuesta de fase aguda es una respuesta fisiologica adaptativa del organismo frente a una inflamacion local aguda, cuyo objectivo es generar condiciones sistémicas que permitan una respuesta infamatoria local mas efectiva. Es gatillada por las citoquinas propotipicas IL-1, TNF-alfa e IL6.
Estas citoquinas son liberadas desde el sitio de inflamación local a la circulación, a traves de la cual alcanzan el hipotámo, el higado y la médula osea. Su accion sobre el hipotámo produce fiebre y un aumento en la secreción de ACTH, la cual a su vez estimula la secreción de cortisol por las glandulas suprarenales.
En el hígado aumenta la sintesis proteica dirigida fundamentalmente a proteínas que favorecen el reconocimiento y eliminación de los patógenos , tales como la proteina C reactiva, las lecitinas de union a la manosa y factores del complemento.
Por su parte, en la medula ósea aumentan los niveles de factores estimuladores de colonias, con lo cual se estimula la hematopoyesis y se movilizan células inmunes hacia la circulación.19
ACTIVACION DE LA RESPUESTA INMUNE INNATA
1-La inmunidad innata es la forma antigua y universal de defensa contra la infección, tiene un número limitado de receptores codificados (PRRs) en los monocitos, macrófagos, polimorfonucleares que reconocen estructuras microbianas conservadas, que se encuentran en los agentes infecciosas llamadas patrones moleculares asociado a patógenos (PAMPs) y distingue lo infeccioso de lo no infeccioso. Participa en la generación de la inmunidad adaptativa
2-El sistema inmune se caracteriza por ser la primera linea de defensa contra microorganismos patógenos. Se constituye de diversos tipos celulares, entre los que se destacan los monocitos-macrófagos y los neutrofilos, de barreras fisicas (epitelios, cilios) y de factores solubles (complemento, defensinas)
3-A diferencia de la inmunidad adquirida, la inmunidad innata se encuentra, fija en el genoma, tiene una acción inmediata y en lugar de reconocer antígenos especificos,reconocen patrones moleculares que solo estan presentes en microorganismo extraños.
4-Su rol es fundamental en la sepsis, ya que la activación masiva tanto del complemento como de los monocitos y neutrofilos son los eventos iniciales que gatillan la respuesta inflamatoria sistémica 20,21,22
CARACTERISTICAS DE LA INMUNIDAD ADQUIRIDA
- Especificidad: Asegura que la respuesta inmune hacia un Ag microbiano sea dirigida hacia ese Ag
- Diversidad
Aumenta la capacidad de combatir reinfecciones por el mismo germen - Memoria
Permite al sistema inmune responder a una gran variedad de Ags - Expansión clonal
Aumenta la cantidad de linfocitos Ag-específicos para mantener el ritmo con los microorganismos - Especialización
Genera respuestas que son óptimas para defenderse de diferentes tipos de microorganismos - Contracción y homeostasis
Permite al sistema inmune recuperarse de una respuesta de modo que pueda responder eficazmente ante un nuevo ingreso de Ags - No reactividad hacia lo propio
Previene el daño hacia el hospedero durante las respuestas hacia Ags extraños (23)
Hay Mediadores solubles de la Inmunidad INNATA Y ADAPTATIVA, por medio de ellas los leucocitos se comunican entre si y con otras células, estos mediadores son:
- La citocina
Que agrupa a aquellas moléculas secretadas por linfocitos (linfocinas) o a las secretadas por monocitos y macrófagos (monocinas) Son proteinas secretadas por las celulas de la I Innata y adaptativa en respuestas a PAMPs (LPS, endotoxinas, peptidoglicanos),varias citosinas se denominan “interleucinas” (IL) haciendo referencia a que son secretadas por leucocitos y actúan sobre otros leucocitos. Se han identificados al menos desde la IL-1 a IL-35, otras se denominan “interferones” (cuando interfieren en las infecciones virales) otras “hematopoyetinas” (si intervienen en pasos de la hematopoyesis),”factores de cremientos” y” quimiocinas” (si tienen quimiotácticas)
Quimiocinias:
Su nombre proviene de “citocinas quimiotácticas” poseen propiedades quimioatrayentes, estimulando el movimiento de los leucocitos y regulando la migración de los mismos hacia órganos y tejido,su síntesis puede ser inducida en respuesta a estímulos inflamatorios o puede ser constitutiva.
Las quimiocinas se unen a proteoglicanos de la superficie de las células endoteliales y actúan sobre el rodamiento de los leucocitos sobre el endotelio. Ademas aumentan la afinidad de las integrinas de los leucocitos por su ligandos. este paso es crítico para la adherencia firme de los leucocitos al endotelio.
Las citocinas
• Regulan el tránsito de linfocitos y otros leucocitos a través de los tejlidos linfáticos periféricos
• Favorecen la angiogenia y la curación de las heridas
• Participan en el desarrollo de diversos órganos no linfáticos (24) - Sistema del complemento
Es un importante mecanismo efector de la inmunidad humoral y de la inmunidad innata, consta de proteínas séricas y de superficie celular que interactúan entre ellas y con otras moléculas del sistema inmunitario de una forma sumamente regulada.
Funciones del complemento:
- LISIS CELULAR:(bacterias, virus recubiertos y celulas), mediante lesiones de membrana OPSONIZACION: Colocación de marcas reconocibles para que los leucocitos macrófagos puedan efectuar fagocitosis.
- LIBERACION DE MOLECULAS MEDIADORAS: de reacciones inflamatorias e inmunitarias (migración de leucocitos).
- REGULAR LA ACTIVIDAD: biologica celular.
Son activadas por 3 VIAS
En la ruta clásica (incluyendo el sistema de ataque a la membrana), los componentes son (según su orden de actuación),C1q, C1r, C1s, C4,C2,C3,C5, C6, C7, C8 y C9,muchos de elllos son proenzimas (cimógenos), que requieren su ruptura proteolítica para convertirse en enzimas activas
Vía clasica conecta con el sistema inmune adaptativo por medio de su interacción con inmunocomplejos.
Vía AlternativaLa ruta alternativa conecta con el sistema de inmunidad innata, interaccionando directamente con la superficie del microorganismo.
Via de la LectinaLa ruta de las lecitinas es una especie de variante de la ruta clásica, pero que se inicia sin necesidad de anticuerpo, y por lo tanto pertenece al sistema de inmunidad innata.
Las tres vías son el final común de formación del complejo de ataque a membrana.
MEDIADORES DERIVADOS DE LA ACTIVACION DEL COMPLEMENTO
- La activación del complemento por cualquiera de sus vías converge en el factor C3, cuyos clivaje genera subunidades pequeñas-C3a y luego C5a, que cumple importantes funciones regulatorias, como quimioatractante y como anafilotoxinas.
- C5 se eleva significativamente en la sepsis y constituye un mediador fundamental en su patogenia. Actua sobre las células epiteliales y los macrofagos induciendo un gran aumento en la producción de citoquinas y otros mediadores proinflamatorios, sobre el endotelio aumentando la permeabilidad vascular y sobre los neutrofilos actúa como quimiotáctico.
- Sin embargo, también puede contribuir a la inmunoparalisis, ya que disminuye fuertemente la capacidad inmune de los neutrofilos, mientras que sobre los linfocitos induce apoptosis.
- Diversos estudios experimentales en sepsis han demostrado que el bloqueo de C5a o de su receptor aumenta significativamente la sobrevida. La investigación con anticuerpos anti-C5a aún se encuentra en etapa preclinica. 25,26,27,28
MEDIADORES LIPIDICOS
Derivan del metabolismo de fosfolipidos de membrana, los cuales por acción de la fosfolipasa A2 (PLA2) generan ácido araquidonico, el cual es el precursor de todos los eicosanoides. Adicionalmente se sintetiza un fosfolipido conocido como factor activador de plaquetas (PAF) el cual cumple un rol protagónico en la sepsis
- 1)El acido Araquidonico:
Presenta dos vías, la via de la ciclooxigenas (COX), da origen a prostaglandinas y tromboxanos y la via de la lipooxigensa determina la formación de leucotrienos.- La via de la cicloxigenasa (COX) COX1, cuya expresión es constitutiva y la COX2, cuya expressión es inducible y se activa en estados inflamatorios.Durante la sepsis se induce tanto la activdad de PLA 2, como COX2, lo cual deriva en una gran produccion de mediadores lipidicos.
- La via de la lipooxigensa determina la formación de leucotrienos,
a-)Los leucotrienos (B,C,D y E) favorecen la quimiotaxis y leucostasis de macrofagos y neutrófilos, además de promover la adhesión al endotelio
b-)Los leucotrienos (B,C,D y E) Estimulan la degranulación de los neutrofilos, con la consecuente liberación de enzimas lisosomales.
c-)Los leucotrienos (B,C,D y E) Aumentan la permeabilidad vascular por medio de la contracción de células endoteliales adyacentes, incrementando asi el diámetro de los poros interendoteliales y disminuyen el flujo coronario, mesente♪rico y la contractilidad miocárdica.
d)Los leucotrienos (B,C,D y E) su efecto vasconstrictor es moderado, pero incrementan el efecto vasoconstrictor de adrenalina y noradrenalina
- 2)Mediadores lipidicos prostaglandinas:
Las prostaglandinas vasodilatan e incrementan el flujo sanguíneo, con lo que mejoran la perfusión tisular e incrementan el efecto de la serotonina y las bradicininas sobre la permeabilidad vascular. La prostaglandina E2 inhibe la producción de IL-1 y TNF-alfa en una dosis dependiente e inhibe la proliferación de linfocitos T, B y la activación de macrófagos y polimorfonucleares .Promueve ademas el catabolismo muscular. - 3)Mediadores lipidicos:
Tromboxano A2-Prostaciclina
La prostaciclina es un poderoso vasodilatador por acción directa sobre el músculo liso vascular. Previene la formación de trombos, inhibiendo la adhesión y agregación plaquetaria y puede presentar propiedades fibrinoliticas.
El tromboxano A2 es un potente vasoconstrictor que estimula la agregación plaquetaria y la activación de polimorfonucleares, además de aumentar la permeabilidad vascular.
Mediadores lipidicos:
PAF (Factor activador de plaquetas):
PAF es un potente mediador proinflamatorio producido por monocitos, macrófagos tisulares y células cebadas, cuya acción primordial es la activación de los neutrofilos, favoreciendo la adhesión al endotelio, así como la degranulación y la producción de radicales libres de oxígeno .Numerosos estudios han mostrado que el PAF tendría un rol importante en la patogenia de la sepsis y que su producción estaría aumentada en la Sepsis, sin embargo, estudios clinicos recientes que emplearon antagonistas del receptor de PAF en pacientes con sepsis severa no encontraron ningun beneficio clínico . 29,30ESPECIES REACTIVAS DEL OXIGENO Y DEL NITROGENO.
El organismo metaboliza continuamente enormes cantidades de oxígeno y de nitrógeno. La gran mayoría de los productos de este metabolismo son moléculas estables e inocual que son fácilmente excretadas. Sin embargo, en condiciones normales una pequeña fracción de oxigeno (1%) y del nitrógeno da lugar a metabolitos intestables y altamente reactivos que pueden alterar la estructura de otras moléculas.
Las especies reactivas pueden producir daño en proteinas, lípidos e incluso ácidos nucleicos. En condicones fisiológicas, su potencial reactivo es rapidamente neutralizada por la acción por de diversos antioxidantes tanto enzimáticos como no enzimático. Las especies reactivas del oxígeno más importantes son el superóxido, el peróxido de hidrógeno y radicales hidroxilo, mientras que la especie reactiva del nitrógeno más importantes el el peroxinitrito. Algunas de estas moléculas cumplen importantes funciones de señalización. Durante la sepsis se produce un aumento importante de especies reactivas y una depleción de algunos antioxidantes. Estos se debe, por un lado, al aumento del metabolismo, pero fundamentalmente a la activación masiva de los neutrofilos,los cuales sintetizan grandes cantidades de especies reactivas para favorecer su acción litica sobre los patógenos fagocitados.Si la mayor generación de especies reactivas no logra ser compensada por una mayor actividad antienzimática se establece un estado de estrés oxidativo que puede resultar en daño celular funcional como estructural.Se han investigado numerosas estrategias dirigidas dirigidas a aumentar la capacidad antioxidante en la sepsis, donde los resultados más promisorios se han obtenido con glutamina, selenio y glutatión. 31
OXIDO NITRICO
El óxido nítrico (NO) es un potente vasodilatador endógeno liberado por las células endoteliales.Su función primordial es modular el tono de la musculatura lisa vascular,se produce por acción de la enzima óxido nítrico sintetasa (NOS) a partir del precursor L-arginina.
Se reconocen diversas formas de la enzima, entre las cuales destaca la forma inducible (iNOS), que se sobreexpresa durante los estados inflamatorios, en la sepsis su actividad genera un marcado aumento en los niveles de NO, el cual contribuiría a la vasodilatación sistémica que frecuentemente acompaña a la sepsis severa. El NO ha sido uno de los mediadores más estudiados en la sepsis, pero su rol sigue siendo controversial.En el pasado se intento corregir la hipotensión asociado al shock séptico mediante el uso de antagonistas de La NOS. En un estudio clínico multicéntrico en que se empleo un antagonista no selectivo de la NOS se logró disminuir el uso de vasopresores, pero este efecto se asoció a un marcado aumento en la mortalidad, por lo que el estudio se suspendió anticipadamente,este análisis confirmó que el NO cumple diversas funciones fisiológicas que pueden ser protectoras durante la sepsis, algunos autores han planteado que los efectos adversos observados en el estudio precedente se deben al bloqueo de las formas constitutivas de la NOS, por lo tanto se siguen buscando alternativas terapéuticas que permitan bloquear selectivamente los efectos vasodiatadores del NO producido por la iNOS. paradójicamente, otros autores buscan estrategias que permitan aumentar los niveles de NO basados en evidencia que indica que ello podría revertir las alteraciones microcirculatorias que caracterizan a la sepsis.Esta controversia refleja que el NO es un mediador tremendamente complejo en la sepsis y que aún no existe claridad respecto de la conveniencia de modular su actividad farmacológicamente. 32
CONCLUSIONES
La fisiopatologia de la sepsis involucra inicialmente la activación global del sistema inmune innato, con la consecuente respuesta inflamatoria sistemica.. La masiva activación de monocitos y neutrófilos se asocia tempranamente a una activación del complemento, del endotelio y de la coagulación, diversos mediadores son liberados a la circulación sistémica, lo que amplifica la respuesta inflamatoria,sin embargo, esta respuesta es altamente dinámica y en pocos días la respuesta hiperinflamatoria puede atenuarse y dar lugar a un estado de inmunoparalisis.
En los casos más severos, la sepsis puede determinar disfunción multiorgánica, intestabilidad cardiovascular, hipoperfusión tisular y eventualmente, la muerte del paciente.Actualmente, el tratamiento de la sepsis consiste fundamentalmente en el tratamiento del foco infeccioso y en medidas de soporte para los órganos en disfunción.A pesar de las décadas de investigación en torno a la fisiopatologia de la sepsis y del desarrollo de numerosas terapias especificas que modifican la respuesta del huesped ninguna de la terapias inmnomodulatorias han demostrado con claridad ser efectiva para mejorar la sobrevida. Esto refleja la complejidad y diversidad de la fisiopatología de la sepsis
ESTIMACION PRONOSTICA EN LA IRA.
Existen multitud de sistemas prónosticos, pero en este revisión de IRA y sepsis vamos a hablar de dos.
APACHE:
Existe tres versiones del mismo del mismo, de los cuales el APACHE II es el de uso mas extendido, emplea tres componentes de cálclulo: la situación fisiológica actual, la edad y la comorbilidad (Tablas 11a,11b,11c):
Codificación de la edad para APACHE II
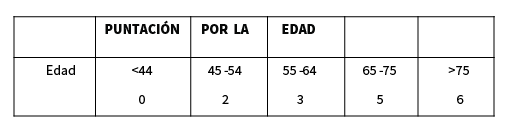
Codificación relacionada con la comorbilidad para APACHE II

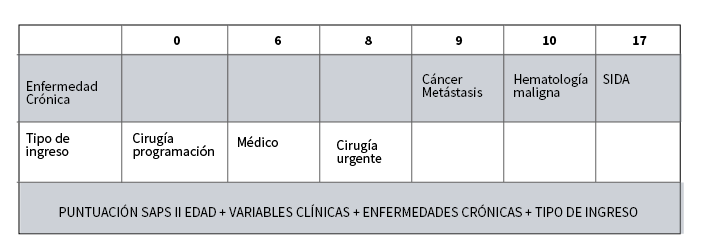
SAPS II (Score de falla renal simplicada)
Es un sistema pronóstico cada vez mas difundido. Diversos trabajos muestran su utilidad en la IRA. Por su diseño no es aplicable a enfermos quemados, coronarios, o intervenidos de cirugía cardíaca. Se calcula sumando las puntuaciones de cuatro áreas.
- La edad
- El peor valor de las variables clínicas observadas el día de realización dell SAPS.
- Los puntos atribuidos a los factores de cormorbilidad que se considera
- Los asociados con la razón del ingreso del enfermo.(ver Tabla 12a, 12b,12c) y las definiciones de las variables en la ( Tabla 13)(35)
Codificación de la edad y las variables clínicas para calcular el índice SAPS II


Codificación de enfermedad crónica y del tipo de ingreso para calcular el índice SAPS II
Definiciones de las variables empleadas en el SAPS II
SOFA (Sepsis Organic, Failure Assessment)
Este sistema pronóstico forma parte de un grupo que se caracteriza por medir como factores pronósticos el número de órganos o sitemas en fallo en un determinado paciente.
El Sofa se desarrolló para calcular la morbilidad de enfermos con sepsis en la Terapia Intensiva.
Valora el nivel de deterioro de seis sistemas orgánicos, pero no incluye datos, referentes a la edad, ni a factores de comorbilidad
- Sistema respiratorio (PaO2/FiO2).
- Sistema hematológico (plaquetas)
- Sistema cardiovascular (hipotensión o uso de fármacos vasoactivos)
- Sistema hepático (niveles de bilirrubina)
- Sistema nervioso central (escala de Glasgow)
- Sistema renal (niveles de creatinina y volumen urinario).
A cada una de las variables se le otorga según el nivel de afección de 0 a4 según el nivel de afección (Tabla14) por lo que su valor puede ir de 0 a 24 puntos
Codificación de variables clínicas para el índice SOFA
quickSOFA
En 2016 SCCM/ESICM (equipo de trabajo) han descripto un score llamado quick SOFA con el objectivo , de evaluar a los pacientes fuera de Unidad de Terapia
Intensiva, que sirva para identificar pacientes con riesgo potencial de sepsis. Este score es una versión modificada del SOFA.
El qSOFA es un score fácil de calcular y toma solamente tres componentes
- Frecuencia Respiratoria >22/minuto
- Alteraciones mentales
- Presión sistólica < 10mmHg.
Entre 879 pacientes que se encontraban en la guardia con sospecha de infección, el qSOFA y el SOFA, presentaron una mortalidad del 3% con scores menores a 2, versus 24 y 18 % de mortalidad en q SOFA y SOFA marcaban scores mayores al 2. 36,37,38,39.
ISIS ( Índice de gravedad individual)
Desde 1984 se han publicado más de una veintena de estimadores pronóstico específicos para la IRA con características muy heterogéneo.
El ISIS demostró mayor ajuste con la evolución real del paciente y el que ha tenido un uso mas extendido. Su determinación es muy sencilla, ya que se basa en criterios clínicos presentes en el momento de realizar el cálculo y en la edad del enfermo. Como valor añadido presenta tres características
- Mantiene unas características dinámicas por las que sigue siendo útil a lo largo de la evolución de la IRA, a menos durante las dos primeras semanas de curso clínico.
- Permite el cálculo de la gravedad de un grupo de enfermos
- Tiene un umbral discriminativo, cuyo valor es de 0.9, por encima del cual ningún enfermo ha sobrevivido
Su calculo se basa en una simple ecuación lineal:
ISI: 0.032 (edad por décadas)-0.086 (sexo masculino)-0.109 (nefrotoxicos)+0.109 (oliguria)+0.116 (hipotensión)+0.122 (ictericia)+0.150 (coma)-0.154 (consciencia)+0.182 (respiración asistida)+0210.
- Las variables en su ausencia toma valor 0 con excepción de la edad que toma su valor de acuerdo con la década de vida del paciente ej(si tiene 63 de edad la década 7 habra que multiplicar por 0,032)
- En la hipotensión se define con una presión arterial sistólica menor a 100mmHg durante 10 horas, independiente del uso de fármacos vasoactivos.
- La ictericia se define como una concentración de bilirrubina sérica igual o superior a 2mg/dl.
- Coma: cuando la puntuación de escala de Glasgow es igual o inferior a %.
- Nefrotóxicos: es la IRA que tiene ese origen (la IRA secundaria a sepsis, cirugía y otras causas médicas, aunque no figuran en la ecuación, esta implícitamente recogida por el sistema)
- Oliguria: diuresis inferior a 400ml/24hs.(39)
MEDIDAS DE PREVENCION PRIMARIA DE LA IRA
- 1-)Expansión de volumen
La hipovolemia manifiesta o relativa, es un factor de riesgo establecido de IRA , por lo tanto la expansión de volumen es una medida preventiva y eficaz tanto en la la IRA por hipoperfusión renal como por nefrotoxicidad. La expansión debe hacerse con cautela en forma controlada con monitorización hemodinámica, ya que su empleo no controlado tiene sus riesgos inmediatos (congestión pulmonar, aumento de presión intraabdominal), o mas largo plazo se ha visto una asociación entre balance hídrico positivo y mortalidad. Para la expansión de volumen se emplea fluidos de diferentes composición, según el origen de la pérdida de volumen del paciente y también de las alteraciones hidroelectrolíca presentes. - 2)Vasopresores, inotrópicos y vasodilatadores
La preservación o el aumento de la presión de perfusión renal es una medida de prevención con fuertes bases fisiológicas. Esto se puede lograr. Mediante reposición de volumen y/o empleo de vasodilatadores renales, agentes inotrópicos y agentes vasoconstrictores sistémicos que aumenten la presión arterial media (PAM) - 3) Control de glucemia estricto:
En un estudio aleatorizado ya clásico que comparaba el control estricto de la glucemia (80-110mg) con perfusión de insulina en pacientes de UTI frente a control habitual (insulina si glucemia >150mg/dl) se observó que el control estricto se asociaba con un menor mortalidad y además, una reducción del 41% de IRA que precisa Terapia de reemplazo renal, otros trabajo han arrojados resultados contradictorios, con un metaanalisis que sugiere que el beneficio queda restrintrigido a pacientes de UTI quirúrgicos. - 4)Eritropoyetina:
Su potencial beneficio se deriva de su acción antiapoptótica y como factor de crecimiento. - 5)N-acetilcesteina (NAC):
Hay estudios para la prevención de la IRA en cirugía cardiovascular y en pacientes que reciben sustancias de contraste. Se ha descrito como efectos adversos reacciones anafilácticas y complicaciones en contexto de su uso como tratamiento de la intoxicaciones aguda por paracetamol. En pacientes sépticos pueden empeorar la hipotensión y reducir el índice cardiaco, posible explicación de la mayor mortalidad observada en este tipo de pacientes con el uso de NAC. Prevencion primaria de la IRA en cirugia cardiaca.
Los cristaloides
Contienen electrolitos y otras moleculas pequeñas que apenas ejercen presión oncótica y que se mueve libremente en el espacio extravascular
- (ClNa 0.9%). El sodio es un ión predominantemente extracelular, difunde facilmente al espacio intersticial, por lo que solo un 1/3 permanecera en el espacio intravascular, esta capacidad de difundir al espacio intersticial le da la ventaja de ser capaz de reponer pérdidas en este espacio y la desventaja de poder generar con más facilidad edema periférico o pulmonar en caso de exceso de aporte, cuando se administra en grandes cantidades puede producir hipoproteinemia dilucional y acidosis hiperclorémica transitoria, al contener más cloruro que el líquido extracelular
- Ringer Lactato, ligeramente hipotonico, con respecto al sodio y que aporta lactato (que se convierte en bícarbonato en el hígado) como sístema tampón, así como calcio y potasio, parece ser la solución más fisiologica cuando se necesitan volumenes grandes. Es el representantes de lo llamados sueros balanceados, caracterizados por tener una composición similar a la del líquido extracelular, por lo que tienen menores efectos sobre su composición. Como desventajas , en presencia de un daño hepatocelular o una menor perfusión hepatica, en combinación con un componente hipóxico, disminuría el aclaramiento de lactato (que se produce en el higado) generando riesgo de toxicidad cerebral.
- La solución glucosada al 5% facilita el aporte de agua libre, ya que la glucosa es rápidamente metabolizada por la insulina, al ser isosmótica no causa la hemolisis que causaria el agua, se utiliza para la corrección de hipernatremias, evitar la cetosis del ayuno y en el paciente diabético en tratamiento con insulina para evitar las hipoglucemias
- Otras soluciones serían las bicarbonatadas a concentraciones 1 molar (hipertonica) y 1/6molar, reservadas para casos con acidosis y llos salinos hipertonicos a emplear con moderación en hiponatremias graves sintomaticas.
COLOIDES
Contiene partículas que por su alto peso molecular no atraviesan las membranas capilares, de forma que son capaces de aumentar la presión osmótica y retener aguda en el espacio intravascular, además de atraer fluidos desde el comportamiento intesticial al intravascular. Son de dierentes tipos (plasma, albúmina, gelatinas, almidones y dextranos) y con moleculas de diferentes tamaños que determinan su viscosidad y su permanencia intravascular.
Presentan la ventaja de ser agentes expansores plasmáticos al producir efectos hemodinamicos más rápidos y sostenidos que las soluciones cristaloides, precisandose menos volumenes que con estas para conseguir este efecto y de ser más efectivos en el aumento del gasto cardíaco que la sangre, los concentrados celulares y los cristaloides
La desventaja que no pueden suplir el déficit del espacio intersticial, ser más caros y en algunos tipos, poder inducir reacciones anafilactoides o alteraciones de la coagulación. Dado que cuando los capilares pulmonares sufren una agresión se hacen más permeables al paso de los coloides, estos pasarán más fácilmente al intersticio pulmonar pudiendo generar edema, al igual que los cristaloides, aunque de forma más tardía.
PRINCIPIOS GENERALES DE LA FLUIDOTERAPIA
- En casos de sangrado los líquidos a emplear son sangre y sueros cristaloides.
- Los cristaloides son tan eficaces como los coloides para restaurar el volumen intravascular.
- Las pérdidas rápidas o graves de líquido intravascular responden más rápido a coloides, cuando hay perdidas de agua pura se repondrán con suero hipotónicos o con suero glucosado al 5%.
- Las perdidas de iones y líquido se repondrán con salino fisiológico o un suero balanceado.
- El bicarbonato 1/6 M se reservará para revertir la acidosis metabólica.
- El bicarbonato 1 M debe manejarse con precaución.
- Se debe evitar la sobrehidratación
AGENTES VASOACTIVOS
Una vez asegurado el adecuado relleno vascular la siguiente medida será asegurar la adecuada presión de perfusión tisular corrigiendo la hipotensión con agentes vasoactivos.
NORADRENALINA :
Es una catecolamina endógena presente en las terminaciones sinápticas y suupone un 10-20% de catecolaminas adrenales. Su acción deriva del potente efecto alfa y beta 1, siendo despreciable su efecto beta 2. Aumenta la presión arterial sistolíca y algo menos la diastólica, con lo que aumenta la presión de pulso. El gasto cardíaco (GC) se mantiene o disminuye por el aumento de la resistencia vascular sistémica que produce por vasoconstricción del lecho muscccular renal, hepático y mesentérico. El reflejo vagal compensador produce enlentecimiento de frecuencia cardíaca y como consecuencia aumenta el volumen sistólico. En las coronarias aumenta el flujo por un efecto vasodilatador, y por un marcado aumento de la T/A media (PAM). Posee escasos efectos metabólicos y glandulares. Sin embargo la NA, no es una droga libre de efectos adversos potenciales cardiovasculares, isquemia intestinal y periférica y su extravasación en el lugar de inyección puede producir necrosisVASOPRESINA: (VP)
Es una hormona de estrés endógena que, ademas de ser antidiurética, presenta efectos presores. En una situación de shock la hipotensión provoca, entre otras respuestas adaptativas, un incremento en la liberación de la VP, aumentando mucho su concentración, lo cual causa vasoconstricción por varios mecanismo que ayudan a restaurar y mantener la presión arterial. Pese a su alta concentración en un porcentaje de pacientes con shock distributivo hay un déficit relativo de VP. Por todo ello su administración exógena es potencialmente útil en el tratamiento del shock al poder restaurar el tono vascular.La vasopresina posee una serie de efectos complejos en el riñón, aunque en general actua disminuyendo la diuresis para mantener la volemia, puede también tener un efecto diurético en el shock séptico atribuible al menos en parte, a un mayor efecto presor sobre la arteriola eferente que sobre la aferente.
TERLIPRESINA: Es un analago de la vasopresina con una duracion de accion superior y que se encuentra bajo investigación para el tratamiento de la hipotensión refractaria al tratamiento vasopresor convencional. La vida media de la TP es de 6 horas y la duración de su efecto de 2 a 10hs.En algunos estudios recientes en pacientes adultos con shock séptico resistente a la NA parece ser capaz de conseguir un incremento significativo de la PAM con descenso de la frecuencia cardiaca y aumenta el índice cardiaco y el transporte de oxigeno, consiguiendo un efecto beneficioso sobre la función renal y la diuresis.
DOBUTAMINA Es la droga de elección para incrementar el gasto cardíaco. En contraste con el resto de las catecolaminas descriptas, no son sintetizada en el organismo ni tiene efectos renales directos. Actua primariamente sobre la funcion cardiaca al estimular sus receptores beta-1 y tambien estumula los receptores beta 2, produciendo vasodilatacion periferica. La dobutamina puede ser util en la IRA causada o mantenida por el descenso del gasto cardaco al producir aumento de este y subsecuentemente, del flujo plasmatico renal. Las dosis manejada es de 1 a 10ug/kg/min
DIURETICOS DE ASA Los diureticos de asa muestran mucha mayor efectividad en la insuficiencia renal que otros tipos de diuréticos, actuan inhibiendo el transporte de Na en la porción ascendente gruesa del asa e Henle, donde interfieren con la proteina cotransportadora Na-K-2Cl, produciendo una natriúresis que explica su amplio uso en insuficiencia cardiaca y en sobrecarga de volumen.
En estudios de experimentación han demostrado que, al inhibir el transporte de sodio, reducen los requerimientos de energía en las células de la porción gruesa del asa de Henle,lo cual además de reducir el consumo renal de oxigeno, disminuye el compromiso isquémico de la medula externa, zona especialmente sensible al efecto de la hipoperfusión al concentrar una gran cantidad de estos segmentos tubulares.
Además disminuyen el feed-back tubuloglomerular reduciendo así la caída del filtrado glomerular condicionado por éste y favorece el arraste de los restos necróticos y cilindros intratubulares y por consiguiente disminuye obstrucción tubular .
DOPAMINA En un principio se penso que dosis bajas de dopamina en pacientes con función renal de sujetos sanos normovolémicos no anestesiados podian aumentar el flujo sanguineo renal y aumento de la diuresis y natriuresis e hicieron creer un efecto beneficiosos para el manejo de la IRA incipiente o establecida. Efectos sobre la función renal en animales y humanos sanos en el rango entre 0.5 a 15u/kg/min. A medida que se aumenta le dosis, los efectos de la dopamina van evolucionando desde predominantemente dopaminérgicos a beta-adrenergicos y a mayor dosis alfa-adrenergicos. Tras varios estudios iniciales que mostraron gran inconsistencia (ausencia de grupos control y aleatorizacion, escaso número de pacientes, población heterogénea etc), un grupo de estudio prospectivo, aleatorios, doble ciego y controlado con placebo y varios metaanálisis suponen una amplia evidencia de que la dopamina es ineficaz en la prevención y tratamiento de la IRA.
FENOLDOPAN El fenoldopam es un hipotensor, que reduce la presion arterial de forma dosis dependiente mientras preserva el flujo plasmatico renal y el filtrado glomerular, sin efectos sobre la contractibilidad miocardica , es considerado un vasodilatador selectivo renal y mesenterico.40,41,42,43,44,45,46,47.
EFECTOS EN LA PREVENCION Y TRATAMIENTO DE LA IRA: Los primeros estudios aleatorios y controlados mostraron resultado clínico variables. El empleo de este vasodilatador se basa en contrarrestar la activación neurohormonal que acompaña a los estados de hipoperfusion tisular. No obstante el empleo de este agente con lleva como riesgo la hipotensión arterial.
TRATAMIENTO SUSTITUTIVO DE LA FUNCIÓN RENAL
GRADOS DE RECOMENDACIÓN
1º Los pacientes con FRA grave deben ser tratados con técnicas de depuración extracorpórea.
Grado A
2º Las Técnicas Continuas parecen ofrecer ventajas sobre las Intermitentes en pacientes, con mayor severidad y/o inestabilidad hemodinámica. Grado B
3º La dosis en Técnicas Continuas parece ser igual o superior a 35 mL/kg y hora como convección solamente (ultrafiltración) o sumando diálisis y convección (efluente).
Grado A
4º Las Técnicas Continuas se deben recomendar en pacientes con FRA y edema cerebral, o riesgo del mismo.
Grado B

 Figura 1 - FAV safenofemoral
Figura 1 - FAV safenofemoral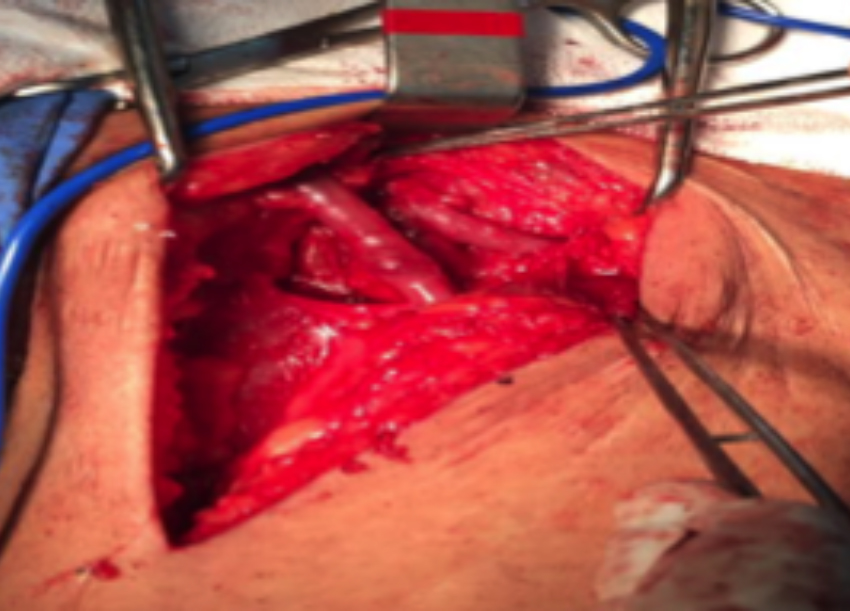
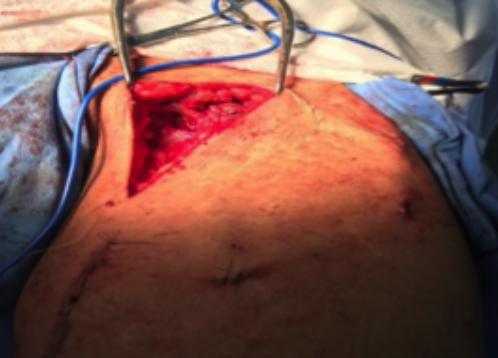
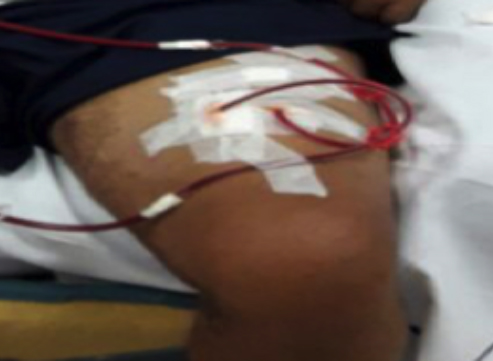
 Tabla 1
Tabla 1